Samenvatting
Verwekker: Hepatitis B-virus (DNA-virus)
Incubatieperiode: 4 weken tot 6 maanden (meestal 2-3 maanden)
Besmettingsweg: Via besmette lichaamsvloeistoffen door verticale, horizontale (binnen een huishouden), seksuele en parenterale transmissieroutes.
Besmettelijke periode: Gedurende de periode dat HBsAg aantoonbaar is in het bloed. Bij symptomatische infectie enkele weken voor de start van symptomen. Bij een chronische infectie tot behandeling of spontane klaring (1% kans per jaar).
Maatregelen: Meldingsplicht groep B2. Bron- en contactopsporing, voorlichting, immunisatie van contacten.
Symptomen: Van subklinisch tot acuut symptomatisch (moe, griepachtige klachten, buikklachten, icterus). Bij een chronische infectie kans op levercirrose, leverfalen en hepatocellulair carcinoom.
blok
Deze richtlijn is ontwikkeld voor zorgprofessionals werkzaam binnen de infectieziektebestrijding. De primaire doelgroepen zijn GGD- en LCI-professionals. Deze richtlijn bevat adviezen, taken en verantwoordelijkheden en vormt een basis voor het nemen van geïnformeerde beslissingen en het maken van beleid in de praktijk. Voor meer informatie zie Ontwikkeling LCI-richtlijnen.
Vastgesteld LOI (Landelijk Overleg Infectieziektebestrijding
): 11 maart 2025. Gepubliceerd: 24 april 2025.
Diagnostiek vastgesteld: juli 2008.
Wijzigingen na vaststelling
- 29 oktober 2025: De arboparagraaf is op organisatorische aspecten aangepast naar aanleiding van het opheffen van de commissie Preventie Iatrogene Transmissie van HBV (hepatitis B-virus ), HCV (hepatitis C-virus ) en hiv (PIT).
- 7 oktober 2025: De meldingscriteria voor acute en chronische hepatitis B zijn gewijzigd. Bij acute hepatitis B zijn de klinische symptomen optioneel gemaakt, omdat een deel van de personen geen klachten heeft. Als iemand niet voldoet aan de klinische symptomen, is een positieve IgM (immunoglobuline M ) anti-HBc een voorwaarde van een acute infectie. Bij chronische hepatitis B is aan de reeds bestaande voorwaarde van een persoon zonder herkenbaar begin van symptomen de voorwaarde van ‘in het afgelopen halfjaar’ toegevoegd, omdat de casus anders mogelijk zou voldoen aan de meldingscriteria voor acute hepatitis B.
- 28 mei 2025: Vanaf 2 juni 2025 komen MSM (mannen die seks hebben met mannen ) en MSM-sekswerkers binnen het Vaccinatieprogramma hepatitis B-risicogroepen in aanmerking voor een gratis gecombineerd hepatitis A/B-vaccin (Twinrix Adult).
Wijzigingen bij publicatie herziene versie
- In de paragraaf Pathogenese wordt voor de fasen bij chronische hepatitis B verwezen naar externe literatuur, in plaats van dat deze fasen worden beschreven in de richtlijn.
- In de paragraaf Ziekteverschijnselen is een nieuwe subparagraaf over hepatitis D opgenomen.
- In de vorige versie van de richtlijn ontbraken de paragrafen Besmettelijke periode en Besmettelijkheid, deze zijn nu toegevoegd.
- In de paragraaf Transmissieroutes is de tekst over hepatitis B in instellingen weggehaald. Instellingen zijn nu kort beschreven in de paragraaf Verhoogd risico op infectie.
- De informatie over actieve immunisatie tegen hepatitis B is zoveel mogelijk opgenomen in de factsheet hepatitis B-vaccinatie.
- Ook de paragraaf Postvaccinatie-titercontrole is opgenomen in de factsheet hepatitis B-vaccinatie.
- Het beleid bij non-responders na hepatitis B-vaccinatie is nu opgenomen in de bijlage Hepatitis B non-responders.
- In de paragraaf Maatregelen ten aanzien van index, contacten en bron is een nieuwe paragraaf over Heropsporing personen met chronische hepatitis B opgenomen.
- De meldingsplicht t.a.v. acute hepatitis B is aangepast: voorheen stond er dat hepatitis A of hepatitis C uitgesloten moest worden, alvorens er gemeld kon worden. Dit is nu verwijderd uit de meldingscriteria.
- De bijlage Praktische uitwerking bepaling anti-HBs-titer na vaccinatie is vervallen. De informatie hierover is terug te vinden in de bijlage Hepatitis B non-responders.
- De bijlage Vergoedingen vaccinatie is vervallen, er wordt een algemeen document gemaakt over vergoedingen van alle vaccinaties, niet alleen van hepatitis B-vaccinaties.
- De bijlage Overzicht HBV-markers en testsituaties heeft een andere naam gekregen: Overzicht HBV-markers, core-only en HBsAg-negatieve HBV-infecties. De inhoud van de oude bijlage Occulte HBV-infecties bij bloeddonoren is hierin opgenomen.
- In de bijlage Overzicht HBV-markers, core-only en HBsAg-negatieve HBV-infecties is nu nieuw beleid geformuleerd bij een geïsoleerde anti-HBc (core-only).
- De Vragenlijst hepatitis B wordt nog voorgelegd aan het LOVI (Landelijk Overleg Verpleegkundigen Infectieziektebestrijding ).
De richtlijn is herzien onder leiding van dr. C.J.G. Kampman, auteur richtlijnen CIb (Centrum Infectieziektebestrijding )-LCI. De arbeidsrelevante aanvullingen zijn geschreven door dr. M. Wijffels-de Groot, bedrijfsarts CIb-LCI.
Achtergronden
Verwekker
Het hepatitis B-virus (HBV) is een klein DNA-virus dat behoort tot de familie van Hepadnaviridae. Hepadnaviridae is een familie van virussen die voorkomen bij mensen, apen en vogels. De familie kent 5 geslachten, waarbij het geslacht Orthohepadnavirus is onderverdeeld in 12 species. De soort hepatitis B komt alleen voor bij mensen (Magnius 2020). Het complete infectieuze virusdeeltje (virion) bestaat uit een lipiden-envelop, waarop het hepatitis B-surface-antigeen (HBsAg) zich bevindt en waarbinnen het HBe-antigeen (HBeAg) ligt. Centraal bevindt zich het nucleocapside, samengesteld uit viraal DNA en DNA-polymerase, omringd door hepatitis B-core-antigeen (HBcAg) (Liang 2009). HBV kan opgedeeld worden in ten minste 10 genetische groepen (genotypen A tot en met J) die een geografische variatie kennen, maar onderhevig zijn aan migratie. De klinische relevantie van de genotypen is onduidelijk. Wel zijn er aanwijzingen dat genotype C geassocieerd is met een hoger risico op hepatocellulair carcinoom (HCC) en genotype A een hoge kans geeft op klaring na behandeling (Lin 2017, Vigano 2018).
Epidemiologie
Verspreiding in de wereld
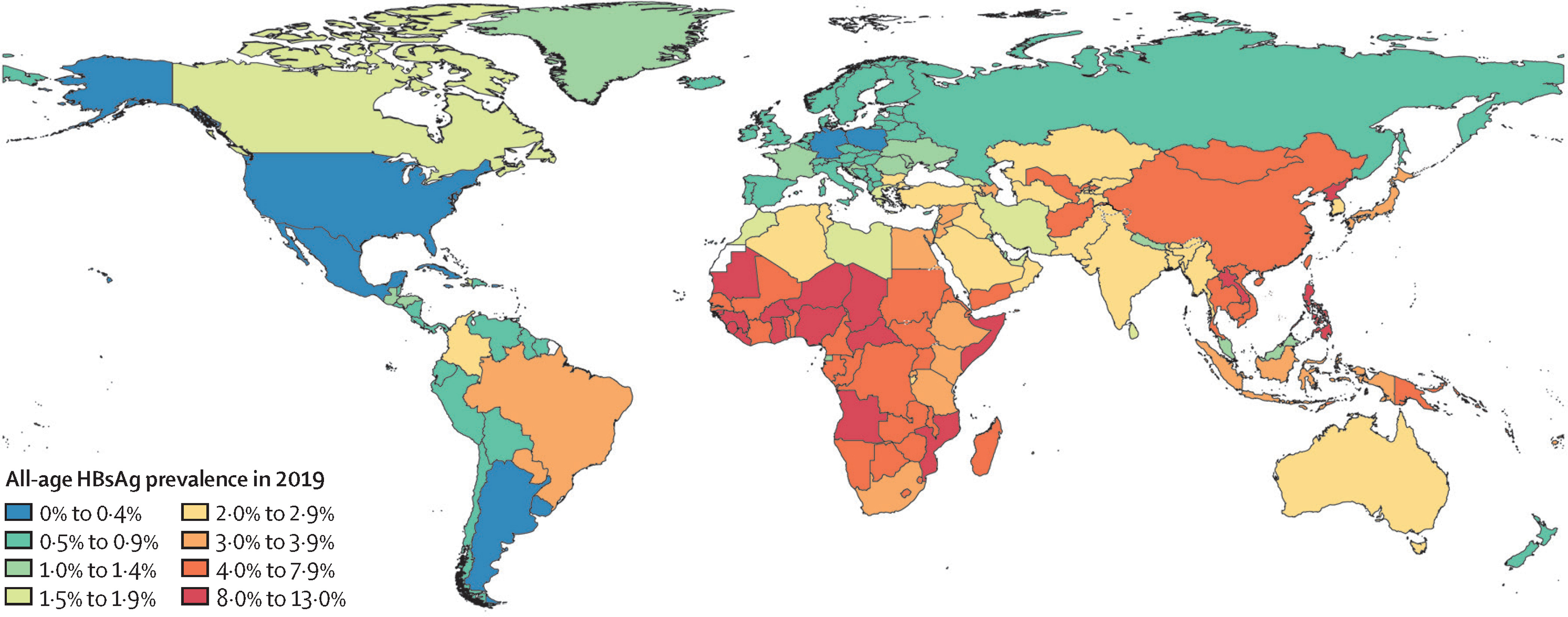
In 2019 hadden er volgens de Wereldgezondheidsorganisatie 296 miljoen personen wereldwijd een chronische HBV-infectie (WHO, 2023). Er komen elk jaar 1,5 miljoen nieuwe infecties bij (WHO 2023). De prevalentie van chronische HBV-infecties varieert in verschillende delen van de wereld (zie figuur). In vrijwel alle landen is de incidentie van acute HBV (doorgaans beschouwd als de eerste maanden bij een eerste infectie) en de prevalentie van chronische HBV-infecties afgenomen, vooral onder kinderen en jongeren. De afgenomen incidentie en prevalentie is het gevolg van universele vaccinatieprogramma’s (Thomas 2019). Uitbraken worden nog steeds gemeld, ook in hogere inkomenslanden, zoals de Verenigde Staten. Door immigratie vanuit endemische landen kan de daling van de prevalentie van chronische HBV-infecties in niet-endemische landen stagneren (Ott 2017, Wong 2021).
Figuur: Prevalentie wereldwijd van chronische HBV-infecties weergegeven aan de hand van een veelgebruikte biomarker, HBsAg, voor het detecteren van een chronische hepatitis B-infectie (GBD 2019)
Voorkomen in Nederland
In Nederland zijn 2023 er circa 40.000 personen HBV-geïnfecteerd. Er zijn 929 HBV-infecties gemeld, waarvan er 839 chronische HBV-infecties of van een onbekend stadium waren en 90 acuut (Kayaert 2024). De meldingen van HBV bleven ondanks coronamaatregelen niet achter bij wat verwacht kon worden op basis van de gegevens over 2015-2019 (Klous 2022).
Acute HBV-infectie
Van 1981 tot 2020 is een dalende trend te zien van het aantal personen met een acute HBV-infectie. De incidentie van acute HBV-infectie daalde van bijna 11 per 100.000 mannen en 3 per 100.000 vrouwen in 1981 naar 0,77 per 100.000 mannen en 0,15 per 100.000 vrouwen in 2022 (Pluijmaekers 2023).
Chronische HBV-infectie
Bij chronische HBV-infectie was er tot 2009 een toename van het aantal gevallen en daarna een afname (van 11 naar 4 per 100.000 personen), zie hiervoor de RIVM-pagina over hepatitis B. Het aantal meldingen van chronische HBV-infecties schommelde rond de 1000 à 1100 meldingen van 2014 tot 2019. In de recentere jaren werden er, mede door COVID-19, minder meldingen van chronische HBV-infecties gedaan (743 in 2021), maar de aantallen nemen inmiddels weer iets toe (839 in 2023) (Pluijmaekers 2023, Kayaert 2024). Personen met een migratieachtergrond die in Nederland wonen hebben een 13-voudig verhoogd risico op HBsAg-positiviteit in vergelijking met autochtone personen (Hahné 2012). Van alle HBV-infecties in Nederland in recente jaren (2018-2023) is 91% onder personen met een 1e generatie migratieachtergrond, waarbij percentueel de meeste chronische HBV-infecties in Nederland voorkomen bij mensen die geboren zijn in Indonesië, Turkije, Syrië en China (Op de Coul, ongepubliceerde data 2024).
Incidentie
- Bloeddonoren
De incidentie van HBV onder reguliere bloeddonoren ligt op 1,0 per 100.000 donorjaren en kende een piek-incidentie in 2017 met 1,9 per 100.000 donorjaren. De prevalentie onder nieuwe donoren lag op 15 per 100.000 donoren en komt van 30 per 100.000 donoren in 2019 (Kayaert 2024).
- Asielzoekers
In een onderzoek uitgevoerd onder 622 asielzoekers in 2016 bleek dat de gemiddelde seroprevalentie van anti-HBs 27% was, 7 personen (1,1%) hadden een chronische HBV-infectie (HbsAg-positief) (Tostmann 2019).
- Mannen die seks hebben met mannen
In 2022 hebben de centra seksuele gezondheid in totaal 25.884 hepatitis B testen verricht, waarvan 58% onder mannen die seks hebben met mannen (MSM). In totaal waren er 53 gevallen van infectieuze (acuut of chronische) hepatitis B, waarvan 42% onder MSM (mannen die seks hebben met mannen ). De meest voorkomende transmissieroute was seks met iemand uit een HBV-endemisch gebied (Kayaert 2024).
- Personen met hiv
Van alle geregistreerde personen met hiv, is 97% ooit getest op HBV, van hen is 5,3% HBsAg-positief getest (van Sighem 2022).
- Zwangeren
In 2022 is 0,2% (323 van de 168.333) van de gescreende zwangeren positief getest op HBV tijdens de prenatale screening (Kayaert 2024). Meer dan 99% van alle zwangeren doet mee aan de screening en dit percentage blijft in de loop der jaren redelijk stabiel. Door deze screening en vaccinatie van pasgeborenen die in meer dan 99% van de gevallen werd toegediend, zijn er geen (of enkel incidentele) infecties met HBV onder pasgeborenen (Visser 2019).
Pathogenese
Na binnenkomst in het lichaam verspreidt het HBV zich via het bloed. Door aanhechting aan specifieke receptoren wordt het virus opgenomen in de levercel. Daar kan het DNA van het HBV ingebouwd worden in de nucleus van de levercellen en dus persisteren in de levercel. HBV geeft zelf geen schade aan de levercellen. De schade wordt veroorzaakt door de immunologische reactie van de immuuncompetente gastheer (Iannacone 2022). Cellen die virusantigenen bevatten, worden door humorale en cellulaire respons van het immuunsysteem opgeruimd.
Als gevolg van een sterke afweerreactie in de acute fase kan een acute symptomatische, soms fulminant verlopende, HBV-infectie ontstaan. Bij een adequate afweerreactie kan het virus dan geklaard worden. Als een HBV-infectie wordt opgelopen op volwassen leeftijd is de kans op het klaren van het HBV ongeveer 95%. Deze kans is een stuk kleiner (5-10%) als HBV op heel jonge leeftijd, met name perinataal, wordt opgelopen (Thio 2019).
Bij een inadequate afweerreactie kan een chronische HBV-infectie ontstaan. Bij een chronische infectie zijn verschillende fasen te onderscheiden, op basis van de aanwezigheid van HBV-antigenen, -antistoffen en -DNA in het serum. Niet elke persoon gaat door alle fasen en ook niet noodzakelijkerwijs in dezelfde volgorde (EASL 2017, Ghany 2021). Voor meer informatie over de fasen, zie de richtlijn van de European Association of the Study of the Liver.
HBsAg-seroconversie (van HBsAg naar anti-HBs) kent een jaarlijkse kans van 1%. Dit doet zich zelden voor tijdens de eerste jaren na infectie. De kans neemt toe na het 50e levensjaar. Naast een hogere leeftijd komt spontane klaring van het HBsAg vaker voor bij mannen, bij lage HBsAg-niveaus en HBeAg-negativiteit (Yeo 2020). Na klaren is er dikwijls nog HBV-DNA aanwezig in de hepatocyten, waardoor reactivatie van HBV kan optreden bij immuunsuppressie (Thio 2019).
Incubatieperiode
4 weken tot 6 maanden (meestal 2 tot 3 maanden) (Jeng 2023). De variatie is afhankelijk van de hoeveelheid virus in het inoculum, de transmissieroute en gastheerfactoren zoals de immuniteit van de gastheer.
Ziekteverschijnselen
Afhankelijk van leeftijd, geslacht en immuunstatus van de gastheer en de infectieuze dosis van HBV ontstaan de volgende verschijningsvormen van een HBV-infectie (Mortimer 1995):
- Acute subklinische HBV-infectie
Bij ongeveer 90% van de kinderen en 70% van de volwassenen verloopt een acute infectie zonder specifieke klachten of verschijnselen (Trepo 2017).
- Acute symptomatische HBV-infectie
Treedt op bij ongeveer 10% van de kinderen en 30% van de volwassenen met een acute HBV-infectie (Trepo 2017). De symptomen houden vaak niet langer dan 6 maanden aan.- Prodromale fase
De prodromale fase duurt enkele weken. Deze fase wordt gekenmerkt door moeheid, griepachtige verschijnselen, een slechte eetlust, misselijkheid (soms met braken), buikklachten (met name in de rechter bovenbuik), soms met koorts en soms met gewrichtsklachten (Pyrsopoulos 2001). - Icterische fase
De prodromale fase wordt na 1 tot 2 weken in een aantal gevallen (14-30% van de geïnfecteerde personen) gevolgd door een icterische fase. Deze fase kan 2 tot 6 weken duren. Er zijn dan specifieke verschijnselen zoals icterus (geelzucht), donkere urine en stopverfkleurige ontlasting (Tillman 2014). In immunocompetente personen kan in zeldzame gevallen (< 1%) een zeer heftige (fulminante) hepatitis B ontstaan die gepaard gaat met leverfalen (Thio 2019, Jeng 2023). - Reconvalescentiefase
Tijdens de 2 tot 12 weken durende reconvalescentiefase verdwijnen de klachten weer.
- Prodromale fase
- Chronische HBV-infectie
Er is sprake van chronisch dragerschap indien het HBV-surface-antigeen (HbsAg) langer dan 6 maanden in het serum aantoonbaar blijft (Terrault 2018). Het risico op het ontwikkelen van een chronische HBV-infectie varieert van 90% bij de pasgeborenen, 25% tot 30% bij kinderen onder de 5 jaar tot minder dan 5% bij volwassenen (Lok 2007, EASL 2017, Terrault 2018). Een chronische HBV-infectie heeft een breed scala aan ziekteverschijnselen en beloopsvormen, variërend van asymptomatisch bij chronische inactieve HBV-infectie tot ernstig ziek zijn bij het eindstadium van de leverziekte. Ook kan er reactivatie optreden (‘flares’) met klachten van een acute symptomatische hepatitis. Ernstige complicaties van een chronische HBV-infectie zijn:- Levercirrose
Het resultaat van jarenlange ontsteking en pogingen tot reparatie van hepatocyten. De klachten die passen bij een gedecompenseerde levercirrose zijn vermoeidheid, icterus, splenomegalie, ascites, slokdarmvarices, hepatische encefalopathie en perifeer oedeem (Thio 2019). Per jaar ontwikkelt gemiddeld 6% van chronisch HBV-geïnfecteerde personen levercirrose, met een 5-jaars cumulatieve incidentie van 8 tot 20% in een onbehandelde chronische HBV-infectie (Fattovich 1991, Ganem 2004). - Leverfalen
Leverfalen kan in elke fase van een chronische HBV-infectie optreden. Het kan ontstaan door een acute exacerbatie van een chronische HBV-infectie, door een immuunsuppressie-gemedieerde reactivatie of spontaan. De prognose van leverfalen is slecht en kent met name bij een immuunsuppressie-gemedieerde reactivatie meestal een fataal beloop (Oketani 2014). Per jaar treedt er leverfalen op bij circa 3% van de personen met levercirrose (de Franchis 2003). - Hepatocellulair carcinoom (HCC)
80 tot 90% van de personen met een HCC heeft een onderliggende levercirrose, maar een HCC kan ook ontstaan zonder cirrose (Fattovich 2004). Het mechanisme dat verantwoordelijk is voor de ontwikkeling van een HCC is grotendeels onbekend. Het jaarlijkse risico op HCC bij personen met cirrose is 2-5% (Rafetti 2016).
- Levercirrose
Ziekteverschijnselen bij zwangere en pasgeborene
Het beloop van een acute of chronische HBV-infectie in de zwangerschap is in de meeste gevallen gelijk aan personen die niet zwanger zijn. De mortaliteit is niet verhoogd en er zijn geen teratogene effecten (Borgia 2012). Wel zijn er aanwijzingen dat een acute HBV-infectie in de zwangerschap een grotere kans geeft op een laag geboortegewicht en prematuriteit. Bij een chronische HBV-infectie is er een grotere kans op zwangerschapsdiabetes, antepartum hemorragie (vaginale bloedingen na de 20e week) en vroeggeboorte (Jonas 2009).
De meeste pasgeborenen zijn asymptomatisch na een perinatale HBV-infectie. Van deze pasgeboren ontwikkelt 90% een chronische HBV-infectie, waarbij het ALAT (alanine aminotransferase ) normaal of minimaal verhoogd is en er nog nauwelijks of milde leverschade is. Enkele pasgeborenen ontwikkelen een acute symptomatische HBV-infectie, die meestal mild en self-limiting is (Trepo 2017).
Hepatitis D
Bij een ernstig beloop van HBV-infectie kan gedacht worden aan een co- of superinfectie met het hepatitis D-virus (HDV) (Ahn 2014). Hepatitis D kan alleen voorkomen bij HBV-geïnfecteerde personen. Naar schatting is er bij 5% van de HBV-geïnfecteerde personen wereldwijd ook een HDV (hepatitis D-virus )-infectie. Bij een ernstige hepatitis, een onbegrepen opleving van de hepatitis (een ‘flare’) en snelle progressie van de hepatitis Bestaat de mogelijkheid van een co- of super-infectie met HDV (Farci 2012).
Natuurlijke immuniteit
Indien na een infectie een HBsAg-seroconversie optreedt (vorming van anti-HBs en verdwijnen van HBsAg), is er sprake van levenslange immuniteit. Als echter de immuniteit onderdrukt wordt (bijvoorbeeld bij chemotherapie, B-cel-depleterende medicatie of beenmergtransplantatie) is reactivatie mogelijk (Iannacone 2022, Thio 2019).
Reservoir
De mens is het enige reservoir en de enige gastheer. Vooral personen met een chronische HBV-infectie zijn een reservoir voor infecties.
Transmissie
Besmettingsweg
Porte de sortie
Overdracht is bewezen via bloed, transplantatieweefsel, sperma en vaginaal vocht. HBV is ook in lage hoeveelheden aangetoond in lichaamsvloeistoffen zoals speeksel, zweet, tranen, moedermelk, urine en feces (Mahboobi 2012, Komatsu 2012, Knutsson 2000, Zheng 2015). Hierbij is er een relatie tussen de hoeveelheid virus (viraal DNA) in het serum en in deze lichaamsvloeistoffen (Kidd 2006). Hoewel is aangetoond dat er HBV in laatstgenoemde lichaamsvloeistoffen zit, is de transmissie van HBV via deze lichaamsvloeistoffen nog niet aangetoond en wordt de transmissiekans dan ook klein geacht (Mahboobi 2012, Pintilie 2018). Transmissie via bijvoorbeeld het gezamenlijk gebruik van kopjes en bestek is niet aangetoond. Lichaamsvloeistoffen vermengd met bloed (zoals speeksel met bloed, bijvoorbeeld door beten of tandvleeslaesies) kan wel leiden tot een grotere transmissiekans.
Porte d'entrée
Transmissie vindt plaats door contact met HBV-besmette lichaamsvloeistoffen. Het virus dringt binnen via de beschadigde huid en intacte slijmvliezen (ook bijvoorbeeld door spatten op het oogslijmvlies). De meest voorkomende transmissieroutes zijn verticale transmissie (zie de paragraaf Zwangerschap: verticale transmissie), horizontale transmissie binnen een huishouden, seksuele transmissie en parenterale (of percutane) transmissie (Jeng 2023).
Transmissieroutes
- Horizontale transmissie
Horizontale overdracht binnen een huishouden is o.a. mogelijk door het gemeenschappelijk gebruik van tandenborstels, nagelschaartjes of scheermesjes, maar ook door andere situaties waarin er bloed-bloedcontact of bloed-slijmvliescontact plaatsvindt (McMahon 2005, Lin 2008). In een review-onderzoek is vastgesteld dat de gepoolde prevalentie van HBV onder niet-immune contacten binnen een huishouden met iemand met HBV 44% is (Sabeena 2022). - Seksuele transmissie
Seksuele transmissie van HBV kan plaatsvinden door middel van contact tussen HBV-geïnfecteerde lichaamsvloeistoffen (zoals sperma, vaginaal vocht, (menstruatie)bloed, voorvocht) en slijmvliezen (genitaal, anaal en oraal) van niet-immune personen. Hierbij geeft receptieve anale seks het grootste risico op HBV (als gevolg van scheurtjes die kunnen ontstaan in het slijmvlies), gevolgd door genitale en orale seks (Handsfield 2005, Remis 2000). De kans op transmissie bij orale seks is klein, tenzij er laesies in het mondslijmvlies zijn (zoals bloedend tandvlees of ulcera in de mond) (Edwards 1998). - Parenterale transmissie
In de gezondheidszorg is overdracht mogelijk via besmette instrumenten (zoals naalden of endoscopen), besmette donorproducten of contact met lichaamsvloeistoffen (Morris 2006). Bij intraveneuze druggebruikers is overdracht mogelijk via gemeenschappelijk gebruik van naalden. Parenterale transmissie is ook mogelijk via tatoeage, piercing, acupunctuur en andere huid-doorborende technieken (Cohen 2021, Rempel 2016). Ook bijtverwondingen en het prikken aan een naald kunnen een mogelijke transmissieroute zijn, zie hiervoor de Landelijke richtlijn Prikaccidenten.
HBV wordt niet overgebracht door gezamenlijk gebruik van bestek of kopjes, knuffelen of hoesten, via zoenen of niezen of via huid-huidcontact bij een intacte huid. Er is ook geen bewijs voor transmissie via een feco-orale route of via vectoren (insecten) (CDC 2021, CDNA 2017).
Transmissie bij zwangere en pasgeborene
- Zwangerschap: verticale transmissie
Verticale transmissie kan op verschillende manieren plaatsvinden: in utero, perinataal of postnataal. - Intra-uteriene transmissie
Intra-uteriene transmissie van HBV is een zeldzame vorm van transmissie. Hoewel het mechanisme van intra-uteriene transmissie grotendeels onbekend is, is er wel een associatie met een hoge viruslading (HBV-DNA) en HBsAg-/HBeAg-positiviteit bij de moeder (Wiseman 2009, Xu 2002). Indien de zwangere een acute HBV-infectie doormaakt, is er een kans van circa 60 tot 90% op intra-uteriene transmissie in het derde trimester (Ranger 2004, Gambarin 2007). Transmissie na een vruchtwaterpunctie bij een HBV-geïnfecteerde zwangere is erg laag (Alexander 1999).
- Perinatale transmissie
Overdracht van moeder naar kind rondom de geboorte wordt perinatale transmissie genoemd. Naar schatting wordt wereldwijd ongeveer 50% van alle nieuwe HBV-infecties perinataal opgelopen (Jonas 2009). Er is sprake van een perinatale overdracht als de pasgeborene binnen 6 maanden HBsAg-positief wordt. Belangrijk om te vermelden is dat maternale antistoffen (anti-HBe en anti-HBc) en ook HBeAg door de placentabarrière kunnen en nog tot 24 maanden in de pasgeborene positief kunnen blijven (Wang 2005). Indien de moeder HBeAg-positief is, dan is de kans op transmissie naar het kind veel groter (70-90%) dan bij een HBeAg-negatieve moeder (10-25%) (Borgia 2012).
- Postnatale transmissie
In borstvoeding van HBV-geïnfecteerde moeders kan zowel HBsAg als HBV-DNA gedetecteerd worden. Moeder-naar-kind-transmissie via borstvoeding is niet aangetoond (Chan 2011, De Oliveira 2009, Beasley 2009, Belopolskaya 2021). Het geven van borstvoeding aan kinderen die HBIg (hepatitis B-immunoglobulinen) en vaccinatie hebben ontvangen is hierdoor niet gecontra-indiceerd (Chen 2013, Chowdhury 2009, Belopolskaya 2021). Horizontale transmissie binnen het gezin is ook een postnatale transmissieroute, zie hiervoor de paragraaf Besmettingsweg.
Besmettelijke periode
Personen met een (acute, dan wel chronische) HBV-infectie worden over het algemeen als besmettelijk beschouwd gedurende de periode dat HBsAg aantoonbaar is in het bloed (Smalls 2019). HBsAg kan al vanaf 1-2 weken, maar uiterlijk tot 11-12 weken na blootstelling voor het eerst gedetecteerd worden (Haber 2021). Bij een symptomatische HBV-infectie start de besmettelijke periode enkele weken voor het ontstaan van de klachten (Hollinger 2006, CDNA 2017). Na het klaren van een HBV-infectie (HBsAg-negatief), kan reactivatie van de infectie optreden als gevolg van immuunsuppressie (Smalls 2019). Hierbij zijn de serumniveaus van HBV-DNA en HBsAg opnieuw hoog en is de persoon ook opnieuw besmettelijk (Chang 2022).
Personen die het virus chronisch met zich meedragen (HBsAg-dragers) kunnen het virus ook altijd overdragen, totdat zij behandeld worden of spontaan klaren. De kans op spontane klaring is jaarlijks ongeveer 1% (Thio 2019).
Besmettelijkheid
De minimale infectieuze dosis van HBV is laag, met ongeveer 10 HBV-DNA-kopieën in experimentele condities (Komiya 2008). Bij een prikaccident aan een naald met HBV-besmet bloed kan het risico op HBV-infectie oplopen tot 25% (CDC 2001). Deze kans is groter bij een prikaccident met bloed van een HBeAg-positieve bron: uit onderzoek is gebleken dat seroconversie bij een gastheer na een prikaccident 37 tot 62% is bij een HBeAg-positieve bron en 23 tot 37% als de bron HBeAg-negatief is (Scott 1980, Powell 1985). In het algemeen is een hogere virale landing (HBV-DNA) bij de bron geassocieerd met een grotere kans op infectie en seroconversie bij een gastheer (Tufon 2019, Sun 2014).
HBV kan 7 dagen overleven buiten het lichaam op verschillende oppervlakken en is in die periode ook potentieel infectieus (Thio 2019, Bond 1981, Than 2019). HBV wordt geïnactiveerd door verscheidene desinfectantia en besmettingen via oppervlakken zijn zeldzaam (CDNA 2017). De overlevingsduur van HBV is kleiner in opgedroogd bloed en groter als het bloed of infectieus materiaal vochtig blijft, zoals in een holle naald (CDC 2015).
Risicogroepen
Verhoogde kans op infectie
- Personen die geboren worden in gebieden waar HBV endemisch is;
- Pasgeborenen van HBsAg-positieve moeders;
- Personen die drugs spuiten en naalden delen;
- Mannen die (onbeschermde) seks hebben met mannen;
- Huishoudcontacten van een persoon met HBV;
- Overige personen die beroepsmatig, door onbeschermd seksueel contact of door reizen naar hoog-endemische gebieden in contact komen met HBsAg-positieve personen (Jeng 2023).
- Binnen instellingen voor verstandelijk beperkten kan de prevalentie van dragerschap verhoogd zijn. In combinatie met specifieke omgangsvormen, zoals bijten, automutilatie en seks, kan er een verhoogde kans op infectie ontstaan (Asensio 2000).
Verhoogde kans op ernstig beloop
Pasgeborenen met een perinatale HBV-infectie hebben een grotere kans (90%) op het ontwikkelen van een chronische HBV-infectie (Belopolskaya 2021, Jeng 2023).
Het risico op levercirrose en HCC is groter bij de aanwezigheid van de volgende factoren (Jeng 2023):
- Gastheerfactoren: mannen, hogere leeftijd, langere infectieduur, het hebben van een afweerstoornis, diabetes mellitus, familiegeschiedenis met HCC, roken en alcoholgebruik (Sinn 2021, Pol 2013).
- Virusfactoren: persisterend hoge virale lading, het HBV-genotype (type C is geassocieerd met een grotere kans op HCC) en co-infectie met hiv, hepatitis C en hepatitis D (Lin 2017, Vigano 2018, Farci 2012).
- Lever-geassocieerde factoren: persisterend hoge ALAT-niveaus, leveraandoeningen.
Behandeling
Zie voor de behandeling van HBV het HBV-richtsnoer. Het doel van behandeling van HBV is het verbeteren van de overleving en de kwaliteit van leven door ziekteprogressie te voorkomen (waaronder levercirrose en HCC). Aanvullende doelen zijn het voorkomen van overdracht, reactivering van hepatitis B en het voorkomen en behandelen van HBV-geassocieerde extrahepatische manifestaties (EASL 2017). Voor personen met hepatitis B zonder behandelindicatie is monitoring belangrijk, om tijdig behandeling te starten als een indicatie ontstaat. De medicamenteuze behandelmogelijkheden (nucleoside/nucleotide analogen en peginterferon alfa) zijn effectief in het onderdrukken van HBV-replicatie, afname van lever-inflammatie en fibrose en reduceren het risico op levercirrose, leverfalen en HCC (Jeng 2023).
Behandeling zwangere en pasgeborene
Zwangeren met HBV lopen een verhoogd risico om de ziekte over te dragen naar het kind. Het HBV-richtsnoer adviseert zwangeren met een significante fibrose of een hoog HBV-DNA te behandelen. De behandeling verlaagt de virale load en verhoogt de effectiviteit van HBIG en vaccinatie ten aanzien van preventie van perinatale transmissie (EASL guideline 2017, Pan 2016).
Pasgeborenen die ondanks passieve en actieve immunisatie HBsAg-positief worden, moeten worden verwezen naar een kinderarts.
Diagnostiek
Zie ook Diagnostisch vademecum hepatitis B.
Diagnostiek berust op het aantonen van antigenen en antistoffen tegen HBV in serum door middel van ELISA (enzym-linked immuno sorbent assay )-technieken. Meestal is 4 tot 8 weken na de besmetting HBsAg en vervolgens HBeAg aantoonbaar.
Vervolgens komt de antistofvorming tegen HBcAg (anti-HBc) op gang: eerst IgM (immunoglobuline M )-anti-HBc, later IgG (immunoglobuline G )-anti-HBc. Een hoge IgM-anti-HBc kenmerkt een recente acute infectie (of opvlamming bij een chronische infectie). Bij het merendeel van de patiënten komt vervolgens ook de antistofvorming tegen HBeAg (anti-HBe) en als laatste tegen HBsAg (anti-HBs) op gang (na enkele weken tot maanden). Indien HBsAg volledig is verdwenen en anti-HBs aantoonbaar is, wordt de patiënt als genezen en levenslang immuun beschouwd. Indien chronische infectie ontstaat, blijft HBsAg aanwezig in combinatie met HBeAg of anti-HBe en in afwezigheid van anti-HBs. Virusreplicatie is aantoonbaar met het bepalen van HBV-DNA. In de bijlage Overzicht HBV-markers, core-only en HBsAg-negatieve HBV-infecties is een opsomming van de HBV-markers opgenomen met een korte beschrijving van de toepasbaarheid bij de diagnostiek. Tevens is een aantal testsituaties beschreven.
Diagnostiek bij zwangeren en zuigelingen
Zwangeren
De verloskundige hulpverlener biedt iedere zwangere een screening op hepatitis B aan als onderdeel van de PSIE-screening (prenatale screening op infectieziekten en erytrocytenimmunisaties) in het eerste trimester. Bij een positief testresultaat wordt direct door het laboratorium aanvullend onderzoek (anti-HBc, HBeAg, anti-HBe) uitgevoerd op hetzelfde monster.
Zuigeling van HBsAg-positieve moeders
Ter evaluatie van de postexpositiebehandeling verwijst de JGZ (jeugdgezondheidszorg ) de ouders voor serologisch onderzoek naar de huisarts. Dit onderzoek betreft een HBsAg- en anti-HBs-bepaling en vindt 4-8 weken na de laatste vaccinatie plaats.
Preventie
- Voor het beleid betreffende besmettingsaccidenten, zie de Landelijke richtlijn Prikaccidenten.
- Voor het beleid betreffende seksaccidenten, zie de richtlijn Seksaccidenten.
- Voor het beleid betreffende een pasgeborene van een HBsAg-positieve moeder, zie het draaiboek Prenatale Screening op Infectieziekten en Erytrocytenimmunisatie (PSIE).
- Voor adviezen en beleid bij reizigers wordt verwezen naar het Landelijk Coördinatiecentrum Reizigersadvisering (LCR). Het LCR-protocol hepatitis B is beschikbaar voor abonnees via MijnLCR.
- Voor het beleid in het kader van het RVP zie de RVP-richtlijn Uitvoering.
- Voor hygiënenormen en -adviezen voor sekswerkers, zie de Hygiënerichtlijn voor seksbedrijven en sekswerkers.
Immunisatie
Vaccinatie
Het hepatitis B-vaccin is een vaccin dat gegeven wordt ter preventie van infectie met het hepatitis B-virus. Door vaccinatie kan acute en chronische hepatitis B voorkomen worden en daarmee ook complicaties als levercirrose en leverkanker.
Zie voor uitgebreide informatie over actieve immunisatie de factsheet Hepatitis B-vaccinatie. In deze factsheet staan de indicaties, toepassingen, doseringsschema’s, contra-indicaties, interferenties, veiligheid, bijwerkingen, effectiviteit en beschermingsduur van hepatitis B-vaccinaties beschreven.
Vaccinatieprogramma’s
In Nederland zijn er vanuit overheidswege vier vaccinatieprogramma’s voor hepatitis B:
- Vaccinatie pasgeborene van HBsAg-positieve moeder
Binnen 2 uur na de geboorte wordt HBIg toegediend. De HBV-vaccinatie binnen 48 uur na de geboorde. Het RIVM verzorgt samen met de koepels en beroepsverenigingen de informatie over deze toedieningen. De extra vaccinatie (ook wel HepB-0) valt ook onder het Rijksvaccinatieprogramma (RVP). Voor meer informatie zie de folder Bescherming tegen hepatitis B voor baby’s van dragermoeders en Addendum: Het vaccineren van baby’s van moeders die hepatitis B-drager zijn.
- Rijksvaccinatieprogramma
In 2003 werd het hepatitis B-vaccin opgenomen in het Rijksvaccinatieprogramma voor risicokinderen (kinderen van personen met een migratieachtergrond). Voor alle zuigelingen is een algemene vaccinatie tegen hepatitis B in het RVP opgenomen voor alle kinderen die op of na 1 augustus 2011 geboren zijn. Zij krijgen het DKTP-Hib-HepB-vaccin aangeboden, zie ook DKTP-Hib-HepB-vaccinatie tot 1 jaar op de RVP-site.
- Asielzoekerskinderen in de leeftijd van 0-19 jaar
Asielzoekerskinderen in de leeftijd van 0-19 jaar, inclusief de alleenstaande minderjarige vreemdelingen (amv) worden door de GGD'en gevaccineerd conform het RVP-schema. Zie ook Addendum: Asielzoekerskinderen van het Rijksvaccinatieprogramma.
- Landelijke vaccinatieprogramma hepatitis B-risicogroepen
Er komen twee grote risicogroepen in aanmerking voor kosteloze hepatitis B-vaccinatie: MSM en sekswerkers. Vanaf 2 juni 2025 komen MSM en MSM-sekswerkers binnen het Vaccinatieprogramma hepatitis B-risicogroepen in aanmerking voor een gratis gecombineerd hepatitis A/B-vaccin (Twinrix) indien zij hepatitis A en B niet hebben doorgemaakt of niet (volledig) zijn gevaccineerd. De uitvoering van het programma ligt bij de GGD’en en hun regiopartners. Voor meer informatie, zie het LCI-draaiboek Hepatitis B-vaccinatieprogramma risicogroepen.
Postvaccinatie-titercontrole
De kans op een voldoende antistofrespons na een volledige vaccinatieserie is hoog bij adolescenten, maar neemt af met de leeftijd. Bij mannen en vrouwen zakt deze onder de 95% vanaf respectievelijk 29 en 42 jaar (Vermeiren 2013). Postvaccinatie-titercontrole is over het algemeen niet nodig. In uitzonderingsgevallen wordt het bepalen van een anti-HBs-titer geadviseerd:
- Als blootstelling mogelijk al heeft plaatsgevonden vóór vaccinatie:
- Bij zuigelingen van HBsAg-positieve moeders;
- Bij sekspartners en huisgenoten van een persoon met infectieuze hepatitis B1;
- Na vaccinatie wegens een seksaccident2;
- Na vaccinatie wegens een hoog- en laagrisico prikaccident3.
- Vaccinatie vanwege een beroepsgebonden risico (risicolopers en risicovormers);
- Risicolopers: personen die een grotere kans hebben op het oplopen van HBV, zoals gezondheidszorgwerkers4;
- Risicovormers: personen die risicohandelingen uitvoeren, waarbij de kans op bloed-bloedcontact tussen gezondheidszorgwerker en patiënt groot is5.
- Indien kans op non-respons verhoogd is:
- Gevaccineerden met afweerstoornissen6. Hieronder vallen ook personen met hemofilie of andere ziekten waarbij iemand regelmatig bloedproducten ontvangt, personen met het downsyndroom7 en andere chromosomale afwijkingen die gepaard kunnen gaan met immuundeficiënties;
- Aanwezigheid van meerdere risicofactoren: roken, mannelijk geslacht, leeftijd > 40, hoog BMI (Body Mass Index. De BMI is een index die de verhouding tussen lengte en gewicht bij een persoon weergeeft. De BMI wordt veel gebruikt om een indicatie te krijgen of er sprake is van overgewicht of ondergewicht.) (> 30).
- Wens van de gevaccineerde;
- Ter overweging: bij een hoog-viremische bron (HBeAg-positief, of hoge virale load)1.
- Overweeg ook anti-HBc-bepaling.
- Zie de richtlijn Seksaccidenten.
- Zie de Landelijke richtlijn Prikaccidenten.
- Zie de LCI-richtlijn Hepatitis B-vaccinatie van risicolopend personeel.
- Zie de Landelijke richtlijn Preventie iatrogene transmissie hepatitis B.
- Zie ook de LCI-handleiding Vaccinatieadviezen bij chronisch inflammatoire aandoeningen en de LCI-richtlijnbijlage Hepatitis B non-responders.
- Bij personen met het downsyndroom en een titer tussen de 10-99 IE/l wordt aanvullend onderzoek naar dragerschap aanbevolen (HBsAg en anti-HBc). Dit beleid geldt niet voor kinderen met het syndroom van Down die volgens het RVP gevaccineerd worden tegen hepatitis B. Bij hen volgt na vaccinatie geen titercontrole.
Wanneer men in het verleden wel is gevaccineerd maar geen titer is bepaald, is het advies om per situatie een risico-inschatting te maken en op basis van dit risico een besluit te nemen (titercontrole, booster, of combinatie hiervan of geen actie ondernemen). In alle andere gevallen is het niet nodig om een postvaccinatie-titercontrole uit te voeren.
Interpretatie van de postvaccinatietiter
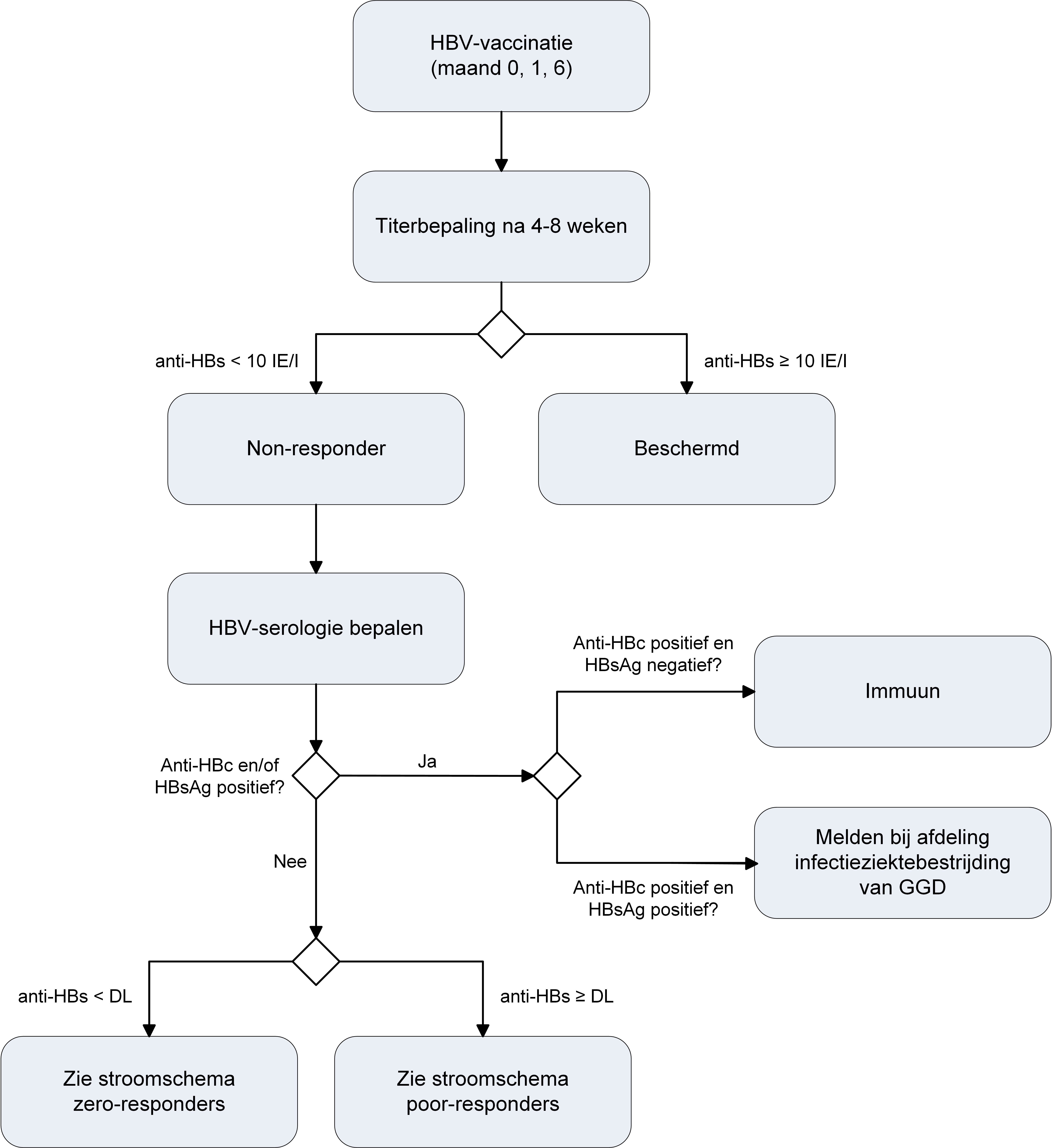
Als grens voor een beschermende antistoftiter wordt een anti-HBs ≥ 10 IE/l 4-8 weken na een volledige serie vaccinaties aangehouden. Dit geldt niet voor risicovormers, dan is een titer van ≥ 100 IE/l geïndiceerd. Zie ook onderstaand stroomschema voor de beoordeling van de titer bij gezonde, gevaccineerde personen.
- Anti-HBs ≥ 10 IE/l
Voor hepatitis B wordt bij een antistoftiter (anti-HBs) ≥ 10 IE/l, 4-8 weken na een volledige serie vaccinaties bij een normale immuniteit uitgegaan van levenslange bescherming en is revaccinatie niet nodig. Voorwaarde voor langdurige bescherming is dat bij de desbetreffende persoon sprake is van een normale immuunrespons. De mate en duur van bescherming bij mensen met een verstoorde immuunrespons is afhankelijk van het soort immuunstoornis. Laat de adviserende rol hierover aan de behandelaar.
Ondanks een titer van ≥ 10 IE/l wordt bij volwassenen toch nog heel zelden hepatitis B waargenomen, hetzelfde geldt bij pasgeborenen van moeders die chronisch hepatitis B-drager zijn (Qin 2018, Chang 2010). Tevens is bij een significant deel van personen met een chronische HBV-infectie een anti-HBs aantoonbaar. Een vaccinatietiter kan dan boven de 10 IE/l zijn; men krijgt de boodschap te zijn beschermd, terwijl er wel degelijk een HBV-infectie is. Een Nederlandse studie vond dat er bij 10% van HBsAg-positieve personen ook een anti-HBs aantoonbaar is (Zaaijer 2002). De anti-HBs titer is dan in de regel tussen de 10 en 99 IU/l. De verklaring voor het gelijktijdig voorkomen van een anti-HBs ≥ 10 IU/l en HBsAg-positiviteit is nog onopgehelderd (Jiang 2021, Heijtink 1982).
Bij risicovormers in de zorg dient de titer hoger dan ≥ 100 IE/l te zijn, omdat er bij een titer tussen de 10 en 99 IE/l sprake kan zijn van een onderliggende chronische HBV-infectie, die soms gepaard gaat met de aanwezigheid van een lage spiegel anti-HBs (Zaaijer 2002). Zie voor het beleid en de titerbeoordeling bij risicovormers de Landelijke richtlijn preventie van iatrogene transmissie van hepatitis B. - Anti-HBs < 10 IE/l
Indien de anti-HBs-titer 4-8 weken na de laatste vaccinatie < 10 IE/l is, dan is er sprake van een non-respons en is bescherming niet volledig. Zie voor het te volgen beleid de bijlage Hepatitis B non-responders.
Zie onderstaand stroomschema voor de beoordeling van de titer bij gezonde, gevaccineerde personen.
Figuur: Stroomschema beoordeling titer gezonde gevaccineerden
DL: detectielimiet (van de betreffende anti-HBs-test)
Passieve immunisatie
Hepatitis B-immunoglobuline (HBIg) heeft een specifieke immuniserende werking tegen het HBsAg. De toegediende antistoffen neutraliseren het virus, waardoor het niet meer kan binden aan de levercel. HBIg biedt bescherming tegen hepatitis B-infectie, onafhankelijk van de immuunrespons van de ontvanger. Dit betekent dat als iemand een non-responder is, maar een verhoogd risico op hepatitis B-infectie heeft (bijvoorbeeld bij een prikaccident), HBIg nog bescherming biedt. Zie voor de indicaties van hepatitis B-immunoglobuline Postexpositieprofylaxe.
Algemene preventieve maatregelen
Preventie is gericht op voorlichting over het vermijden van risicocontacten met potentieel besmettelijke lichaamsvloeistoffen. De volgende maatregelen kunnen genomen worden om transmissie van HBV te voorkomen;
- Vermijden van onveilige seksuele contacten
Condooms bieden een bescherming tegen HBV van meer dan 90% (Marfatia 2015). Vooral bij anale en genitale seks is condoomgebruik belangrijk in het voorkomen van HBV-transmissie. Bij orale seks en kontlikken (rimmen) is er ook een kans op HBV-transmissie, maar deze is kleiner dan bij genitale en anale seks (Edwards 1998). Voor maximale risicoreductie kan er bij orale seks of rimmen een condoom of beflapje gebruikt worden.
- Maatregelen voor reizigers
Vaccinatie tegen HBV wordt aanbevolen voor personen die > 3 maanden in HBV-endemische landen verblijven, en aan Nederlandse personen met een migratieachtergrond die naar het land van herkomst reizen (ongeacht reisduur). Verder kan vaccinatie aangeboden worden aan personen die < 3 maanden op reis gaan en mogelijk risico gaan lopen, zoals tattoos en piercings laten zetten, seksueel contact gaan hebben, of kans maken op een bloedtransfusie (bijvoorbeeld personen met sikkelcelanemie).
- Maatregelen voor injecterende druggebruikers
Sinds de jaren negentig is het lenen van gebruikte spuiten door injecterende drugsgebruikers, drugs injecteren zelf en de de vraag naar spuitomruil, sterk afgenomen (NDM 2023). Voor initiatieven om o.a. HBV-infectie te voorkomen (zoals spuitomruil, vaccinatie en condoomverstrekking), wordt verwezen naar de verslavingszorg.
- Vermijden van overdracht via mogelijk besmet patiëntenmateriaal (door verwonding, spatten)
Het opstellen van hygiënemaatregelen en het in acht nemen van een richtlijn hoe te handelen bij accidenten is de primaire verantwoordelijkheid van werkgever, werknemer en adviserende arbodienst.
- Vermijden van besmette bloedproducten, donormaterialen
Bloed en donormaterialen worden in Nederland getest op HBsAg, HBV-DNA en anti-HBc, waardoor de kans op besmetting via deze routes wordt geminimaliseerd. Tevens worden HBV-positieve personen zo mogelijk behandeld om de kans op besmetting zo klein mogelijk te houden.
Reiniging, desinfectie en sterilisatie
Conform de LCI-richtlijn Reiniging, desinfectie en sterilisatie in de openbare gezondheidszorg.
Maatregelen
Meldingsplicht
Hepatitis B is een meldingsplichtige ziekte groep B2. Dit houdt in dat artsen en hoofden van laboratoria bij vaststelling van de infectieziekte of verwekker dit binnen 1 werkdag moeten melden aan de GGD. De GGD meldt gepseudonimiseerd conform de Wet publieke gezondheid binnen 1 week aan het CIb (Centrum Infectieziektebestrijding ) en levert gegevens voor de landelijke surveillance van meldingsplichtige ziekten.
Acute hepatitis B
- Een persoon met een herkenbaar begin van symptomen (bijvoorbeeld moeheid, buikpijn, verminderde eetlust, intermitterende misselijkheid en braken, geelzucht) en verhoogde serum aminotransferase niveaus,
en/of
- aanwezigheid van IgM anti-HBc
en
- aanwezigheid van HBsAg en/of;
- aanwezigheid van HBV-DNA.
Chronische hepatitis B
- Een persoon zonder een herkenbaar begin van symptomen in het afgelopen halfjaar,
en
- aanwezigheid van HBsAg en/of;
- aanwezigheid van HBV-DNA.
Indien een chronisch dragerschap (positieve HBsAg en/of aanwezigheid van HBV-DNA*) voor het eerst in Nederland wordt vastgesteld, dient dit te worden gemeld. Dit betekent dat chronische hepatitis B meldingsplichtig is, ongeacht of de infectie al eerder in een ander land was vastgesteld. Dit om bronopsporing te verrichten en cliënt (alsnog) te kunnen informeren over hygiënemaatregelen. Tevens kunnen contacten (alsnog) worden beschermd.
* Bij een positieve HBV-DNA zonder een positieve HBsAg kan er sprake zijn van verschillende situaties (zoals een occulte HBV-infectie). In een aantal situaties is er geen sprake van besmettelijkheid voor contacten, waarvoor aangepaste maatregelen gelden. Overleg met de arts-microbioloog over de interpretatie van de diagnostiek bij individuele gevallen. Zie voor meer informatie de bijlage Overzicht HBV-markers, core-only en HBsAg-negatieve HBV-infecties.
Artikel 26-melding
Hoofden van instellingen waar voor infectieziekten kwetsbare populaties verblijven, dienen een persoon met verschijnselen van geelzucht binnen 1 werkdag te melden bij de GGD, conform artikel 26 van de Wet publieke gezondheid. Zie het LCI-draaiboek Artikel 26-meldingen Wpg-instellingen.
Bron- en contactonderzoek
Bronopsporing
Bronopsporing is nodig bij:
- alle gevallen van acute hepatitis B;
- voor het eerst vastgesteld dragerschap van HBsAg;
- eerder vastgesteld dragerschap waarbij dit nog niet gedaan is.
Bronopsporing is de verantwoordelijkheid van de GGD nadat deze een melding van HBV ontvangen heeft.
Bij acute hepatitis B wordt het terugzoeken beperkt tot de maximale incubatietijd van 6 maanden. Omdat bij chronisch geïnfecteerde personen het moment van infectie meestal niet duidelijk is, worden alle mogelijke risicomomenten in kaart gebracht. Bronopsporing en contactonderzoek vinden plaats met behulp van een gestructureerde vragenlijst door een ervaren sociaal verpleegkundige van de GGD (zie hiervoor de Vragenlijst over hepatitis B).
In de praktijk blijkt dat in ongeveer de helft van de chronische hepatitis B-infecties de bron niet is te achterhalen. Indien het vermoeden bestaat dat in de incubatietijd transfusie of invasieve ingrepen hebben plaatsgevonden, dient door de GGD de betreffende zorginstelling ingelicht te worden. Een onderzoek naar eventuele andere infecties en de transmissieroute kan dan worden ingesteld.
Contactonderzoek
De GGD is verantwoordelijk voor de bron- en contactopsporing, de voorlichting aan de persoon met hepatitis B over besmettelijkheid en (waar mogelijk) de bescherming van de contacten. Nadat de GGD een melding van HBV ontvangen heeft vindt (bron- en) contactonderzoek plaats met behulp van een gestructureerde vragenlijst. De contactopsporing beperkt zich niet alleen tot de seksuele partners, maar ook tot andere mogelijke contacten met verhoogd risico. De volgende contacten komen in aanmerking:
- sekspartners;
- personen die dezelfde naald of spuitattributen gebruiken voor injecterend druggebruik;
- huisgenoten (delen slaapkamer en/of badkamer) van HBsAg-positieve personen;
- huisgenoten in een instelling voor verstandelijk beperkten;
- soms verplegend en verzorgend personeel.
Bij HBV is het informeren van huidige en voorgaande sekspartners en huisgenoten gewenst. Bij acute infecties worden alle sekspartners geïnformeerd in de 6 maanden voorafgaande aan de eerste ziektedag; bij dragerschap is deze periode tot minstens 1 jaar terug. Bij een voor het eerst vastgestelde chronische hepatitis B wordt in ieder geval een huisgenoten/gezinsonderzoek verricht, waarbij het gezin/huisgenoten in kaart worden gebracht om gerelateerde HBV infecties in kaart te brengen en HBV-negatieve contacten te immuniseren.
Maatregelen index, contacten en bron
Maatregelen bij index
- Voorlichting aan de persoon met hepatitis B over de transmissieroutes en de daaruit volgende maatregelen om verdere overdracht te voorkomen (zoals het omgaan met besmette lichaamsvloeistoffen, het niet delen van tandenborstels en scheerapparaten en methoden voor veilige seks).
- Iedere persoon met een chronische HBV-infectie dient verwezen te worden naar een hepatitis centrum (HBV-richtsnoer). In de tweede lijn wordt geadviseerd om evntueel dragerschap uit te sluiten met een controle na 6 maanden in geval van acute HBV-infectie of HBV-infectie van onbepaalde duur. Tevens wordt geadviseerd om in het eerste consult co-infecties met hepatitis D, hepatitis C en hiv uit te sluiten (HBV-richtsnoer).
- Indien de persoon met een chronische HBV-infectie anti-HAV-negatief is, is hepatitis A-vaccinatie geïndiceerd. Een co-infectie met hepatitis A bij HBV-geïnfecteerde personen kan zorgen voor een grotere kans op progressieve leverziekten en leverfalen (Henkle 2015). De hepatitis A-vaccinatie kan gegeven worden door de GGD, de huisarts of de specialist, conform lokale afspraken. Volgens de zorgverzekeringswet wordt hepatitis A-vaccinatie vergoed aan personen met een chronische hepatitis B- of hepatitis C-infectie en aan personen met een niet-virale chronische leverziekte.
Maatregelen bij contacten
- Samen met de persoon met hepatitis B de contacten in kaart brengen. Bespreek met de persoon wie een eventuele bron en contacten informeert en hoe. De contacten dienen gescreend te worden op HBV-infectie en dienen dezelfde maatregelen in acht te nemen als de persoon met hepatitis B zolang de testuitslag nog niet bekend is.
- Hepatitis B-vaccinatieaanbieden aan de seronegatieve partner, gezinsleden of huisgenoten van een HBsAg-positief persoon (vergoeding volgens Regeling Zorgverzekeringswet). Nagaan welke andere contacten in aanmerking komen voor passieve en/of actieve immunisatie.
- Bij hoog-viremische dragers (HBeAg-positief of hoge viral load) is het aan te raden om te bekijken of meer maatregelen moeten worden getroffen richting andere contacten. Meestal betreft dit voorlichting over hygiëne en de mogelijkheid tot vaccinatie (bijvoorbeeld op een school). De GGD kan hierover contact opnemen met de LCI voor overleg.
Maatregelen bij bijzondere vormen van hepatitis B
Voor het beleid bij een geïsoleerde anti-HBc, een occulte HBV-infectie en nadere uitleg van HBV-markers, zie bijlage Overzicht HBV-markers, core-only en HBsAg-negatieve HBV-infecties.
Heropsporing personen met chronische hepatitis B
Door verbeterde behandelingsmogelijkheden komen nu meer personen met hepatitis B in aanmerking voor behandeling. Veel personen zijn uit zorg geraakt, door factoren bij de personen zelf (zoals zich niet ziek voelen), zorgverlenerfactoren (bijvoorbeeld niet op de hoogte zijn van nieuwe richtlijnen) en omgevingsfactoren (bijvoorbeeld ingewikkelde zorgpaden). Daarom zijn er in Nederland in negen regio’s heropsporingsprojecten uitgevoerd in 2016. Geen van de projecten had exact zelfde werkwijze, maar ze startten allemaal met identificatie van personen die HBsAg-positief waren. Vervolgens volgde een selectiemethode en ten slotte werden personen opgespoord waarna serologische evaluatie volgde. De belangrijkste succesfactor voor de heropsporing was een goede samenwerking met betrokken partijen (waaronder bij voorkeur samenwerking met één laboratorium). De belangrijkste knelpunten waren de kosten en de flinke tijdsinvestering. Helaas was het niet mogelijk om een analyse te maken van de her-opgespoorde personen, omdat er geen gegevens waren over personen die geen gehoor gaven aan de heropsporing (Dimmendaal 2019).
Maatregelen zwangeren en pasgeborenen
Iedere zwangere met een positieve HBsAg dient verwezen te worden naar een hepatitis centrum ter evaluatie van de noodzaak tot starten van antivirale therapie om het risico op verticale transmissie te verkleinen (HBV-richtsnoer).
- Geef voorlichting over het belang en de uitvoering van het vaccinatieprogramma bij de pasgeborene;
- Geef voorlichting aan de zwangere over de transmissieroutes en de daaruit volgende maatregelen om verdere overdracht te voorkomen;
- Vaccineer onbeschermde seksuele partner(s), overige kinderen en huisgenoten indien zij na testen HBsAg-negatief zijn.
Zie voor meer informatie de Checklist bescherming tegen hepatitis B voor baby’s van dragermoeders.
Het geven van borstvoeding aan kinderen die HBIg (hepatitis B immunoglobulinen) en vaccinatie hebben ontvangen is niet gecontra-indiceerd (Chen 2013, Chowdhury 2009, Belopolskaya 2021).
Postexpositieprofylaxe
Passieve immunisatie is geïndiceerd wanneer directe bescherming tegen HBV nodig is. De HBIg-indicaties zijn:
- Na accidentele blootstelling aan HBsAg-positief materiaal bij niet-geïmmuniseerde personen, zoals in het geval van een prikaccident of seksaccident (zie ook de richtlijnen Prikaccidenten en Seksaccidenten);
- Bij een voortdurend bestaande blootstelling aan hepatitis B-, als vaccinatie tegen hepatitis B niet mogelijk is óf niet tot de vorming van hepatitis B antilichamen heeft geleid;
- Bij pasgeborenen van moeders die chronisch draagster zijn van HBsAg of die tijdens de zwangerschap acute hepatitis B hebben doorgemaakt;
- Bij patiënten die hemodialyse ontvangen, totdat na vaccinatie met een hepatitis B-vaccin, de vorming van antistoffen wordt vastgesteld;
- Ter preventie van hepatitis B-herinfectie na levertransplantatie in geval van hepatitis B-geïnduceerd leverfalen (Farmacotherapeutisch Kompas).
Na een accidentele blootstelling, zoals bij een prikaccident, dient de HBIg zo spoedig mogelijk na het accident toegediend te worden, bij voorkeur binnen 24-72 uur. Als het accident na meer dan 24 uur gemeld wordt, kan overwogen worden om alsnog HBIg toe te dienen tot maximaal 7 dagen na het accident (zie Landelijke richtlijn Prikaccidenten). Als langdurige bescherming nodig is, moet HBIg om de 2 maanden gegeven worden volgens het doseringsschema vermeld in de productinformatie (Farmacotherapeutisch Kompas).
Combinatie actieve immunisatie
Passieve immunisatie moet gecombineerd worden met actieve immunisatie met een HBV-vaccin volgens het schema 0-1-6 maanden, behalve bij non-responders op eerdere vaccinaties of indien bij de ontvanger de uitslagen van HBV-markers later positief blijken te zijn. Bij een prikaccident bij bekende non-responders wordt bij een hoogrisicoaccident in plaats van actieve immunisatie een tweede dosis HBIg toegediend, een maand na de eerste. Zie Landelijke richtlijn Prikaccidenten. De reden dat normaliter ook actieve immunisatie wordt geadviseerd, is verdere reductie van de kans op HBV-infectie of het vaak blijvende risico op hernieuwde blootstelling aan HBV (Wu 2022, Zou 2011).
Voor meer informatie over de contra-indicaties, bijwerkingen, interacties en doseringsschema, zie de SmPC-tekst. Voor de juiste dosering van HBIg bij kinderen van dragermoeders, zie het geneesmiddelen tabblad van het draaiboek PSIE.
Wering
Gezien de wijze van transmissie is wering van school of kinderdagverblijf niet geïndiceerd. De gebruikelijke hygiënemaatregelen ten aanzien van omgaan met bloed en het hanteren van een (prik)accidentenprotocol volstaan. In specifieke situaties (bijvoorbeeld bij een hoogviremische chronisch geïnfecteerde met risicogedrag) kan de GGD vaccinatie van de groepsgenoten overwegen.
Andere protocollen en richtlijnen
- RVP-richtlijn vaccineren van baby’s van moeders die hepatitis B-drager zijn
- Landelijke richtlijn Preventie van iatrogene transmissie van hepatitis B
- Landelijke richtlijn Prikaccidenten
- Richtlijn Seksaccidenten
- Hygiënerichtlijn voor basisscholen
- Hygiënerichtlijn voor kinderopvang
- RVP-richtlijn Uitvoering
- Draaiboek Prenatale screening op infectieziekten en erytrocytenimmunisati (PSIE)
- Checklist voor verloskundigen: bescherming tegen hepatitis B voor baby’s van dragermoeders
- Verpleegkundig stappenplan acute hepatitis
- Verpleegkundig stappenplan chronische hepatitis
- Behandelrichtlijn hepatitis B-virusinfectie (HBV-richtsnoer)
- LCR-protocollen reizigersadvisering (beschikbaar voor abonnees)
- NHG-standaard virushepatitis en andere leveraandoeningen
- Richtlijnen infectiepreventie
- Counseling van chronische hepatitis B-virusdragers (op te vragen via GGD Rotterdam)
- LCI-draaiboek vaccinatieprogramma hepatitis B-risicogroepen
Arbeidsrelevante aanvullingen
Deze aanvullingen zijn geschreven voor en door bedrijfsartsen en beschrijven de preventieve maatregelen om het oplopen van infectieziekten tijdens het werk te voorkomen (werknemer als risicoloper) en de maatregelen/aanpassingen die genomen kunnen worden bij vaststelling van de infectieziekte bij de werknemer (werknemer als risicovormer). In de werksituatie gelden de Arbowet, het Arbeidsomstandighedenbesluit (Arbobesluit) en de Europese Richtlijn 2000/54 gericht op preventie. Zie ook biologische agentia in de wet (Arboportaal.nl).
Achtergrondinformatie over de ziekte en infectiepreventie en -bestrijding is opgenomen in de hoofdrichtlijn. Hieronder zijn aanvullingen toegevoegd in het kader van de preventie van infectieziekten het voorzorgsprincipe voor een optimale werknemersgezondheid en gezonde arbeidsomstandigheden, met specifieke aandacht voor de werknemer als risicoloper en risicovormer.
Ziekteverschijnselen in relatie tot arbeid
Chronische HBV (hepatitis B-virus )-infectie kan een grote psychologische impact op medewerkers hebben, zelfs zonder symptomen van ernstige ziekte zoals levercirrose (Ibrahim 2023, Daida 2020). Succesvolle antivirale therapie kan deze impact beïnvloeden en bijdragen aan veranderingen van mogelijkheden in werk. Symptomen van chronische hepatitis en bijwerkingen van medicatie kunnen effect hebben op het werk en tot beperkingen leiden. Dit moet op individueel niveau worden beoordeeld. De bedrijfsarts kan deze beperkingen duiden.
Arbeidsgerelateerde risicogroepen
Beroepsgroepen met een verhoogde kans op infectie
Risicolopers zijn werknemers die bij het uitoefenen van hun beroep blootgesteld worden aan materialen die HBV (kunnen) bevatten, zoals bloed(producten), transplantatieweefsel, sperma, andere genitale secreta, moedermelk en ander obductie- en niet-gefixeerd pathologisch materiaal (zie Besmettingsweg). Het risico op infectie na een percutaan accident met een bloedhoudende naald bij een bewezen positieve bron wordt op 25% geschat (SRI 2024), tenzij er sprake is van immuniteit op grond van een doorgemaakte infectie of vaccinatie. Onderstaande werknemers zijn risicolopers (niet limitatief, uit de risico-inventarisatie en -evaluatie kunnen ook andere risicolopers komen) (van Wijk 2010).
- Artsen, verpleegkundigen, verzorgenden en paramedici die geregeld met bloed of met lichaamsvloeistoffen zoals serum, ascites, vruchtwater in aanraking komen (Douwes 2008, SRI 2024, RIVM (Rijksinstituut voor Volksgezondheid en Milieu ) 2021, van Wijk 2010, RIVM 2019);
- patholoog-anatomen en werknemers die met niet gefixeerd potentieel besmet materiaal werken;
- personeel van hemodialyseafdelingen, inclusief werknemers in het technisch onderhoud (SRI 2024);
- personeel van laboratoria, dat geregeld met bloed of bloedproducten in aanraking komt (SRI 2024);
- verloskundigen en kraamverzorgenden (RIVM 2021, van Wijk 2010);
- tandartsen, mondhygiënisten, tandartsassistenten en indirect bij de tandheelkundige patiëntenzorg betrokkenen, die mogelijk blootstelling hebben aan HBV (Malsam 2021);
- werknemers die proefdieren verzorgen in laboratoria waar met het hepatitis B-virus gewerkt wordt;
- schoonmaakwerknemers in ziekenhuizen, verpleeghuizen en andere locaties waar potentieel besmet materiaal verwijderd wordt (SRI 2024, RIVM 2019);
- werknemers die niet-gefixeerd, potentieel besmet pathologisch materiaal vervoeren;
- studenten, stagiaires en leerlingen van alle bovengenoemde beroepen en instellingen, die in contact kunnen komen met bloed of besmet materiaal;
- werknemers in de seksindustrie (RIVM 2019, RIVM 2024);
- medewerkers in de uitvaartbranche die met bloedproducten of weefsel in aanraking kunnen komen (Davidson 2006);
- overige beroepen waar blootstelling kan plaatsvinden zoals bij politie, brandweer, defensie, penitentiaire inrichtingen en opvangcentra (van Wijk 2010);
- zakenreizigers of ontwikkelingswerkers die reizen naar endemische gebieden.
Beroepsgroepen met een verhoogde kans op besmetting van (kwetsbare) derden
Risicovormers zijn met HBV besmette werknemers die door de handelingen die ze verrichten een patiënt of client zouden kunnen besmetten. Risicovormende zorgmedewerkers verrichten handelingen waarbij niet steeds zicht is op de handen/vingers terwijl deze in aanraking kunnen komen met scherpe anatomische structuren of voorwerpen (RIVM 2021). Hierdoor is bloed-bloedcontact tussen zorgmedewerker en patiënt mogelijk. In de praktijk zijn dit onder andere handelingen tijdens tandheelkundige ingrepen en thorax-, trauma-, gynaecologische, neurologische en orthopedische chirurgie. Of in de acute zorg; bijvoorbeeld bij traumapatiënten met open weefsel en botbreuken of diep hechten om bloedingen te stoppen kan bloed-bloed contact ontstaan, evenals bij bijtincidenten. Voor een volledig overzicht, zie de bijlage bij de Landelijke richtlijn Preventie iatrogene transmissie van hepatitis B: Examples of UKAP Advice on Exposure Prone Procedures. Buiten de zorg gelden sekswerkers als risicovormers (RIVM 2019).
Werknemers met een verhoogde kans op ernstig beloop
Zie hiervoor Verhoogde kans op ernstig beloop.
Preventieve maatregelen op het werk
Voor meer informatie, zie ook Algemene preventieve maatregelen.
De werkgever van risicolopers is verantwoordelijk voor het geven van (periodieke) voorlichting over werk gerelateerde risicohandelingen, het hebben van een (prik)accidentenprotocol, het zorgen voor kennis hiervan bij werknemers en het houden van toezicht op het naleven van de richtlijnen en protocollen (Overheid 2024, RIVM 2019, SRI 2024).
Daarnaast is deze werkgever verplicht tot:
- het opstellen en bekend maken van ontsmettings- en desinfectieprocedures;
- het opstellen en bekend maken van procedures voor omgang met en verwijdering van biologische agentia/besmet afval/materiaal;
- het, bij gevaar voor letsel, ter beschikking stellen van een medisch hulpmiddel met ingebouwd veiligheids- en beschermingsmechanisme (zoals veiligheidsnaalden);
- het voorlichten over en handhaven van het verbod op het terugzetten van doppen (het zogenaamde ‘recappen’) op injectienaalden;
- het ter beschikking stellen van persoonlijke beschermingsmiddelen die voldoen aan wetten en normen;
- het werken met duidelijk gemerkte en technisch veilige naaldencontainers en afvalcontainers die voldoen aan gestelde wetten en normen;
- het hebben van een actief beleid ten aanzien van het werken met scherpe medische hulpmiddelen en periodieke risicobeoordeling.
De werkgever moet daarnaast vaccinatie tegen hepatitis B aanbieden aan risicolopers. Sekswerkers komen in aanmerking voor een gratis vaccinatie tegen hepatitis B bij de GGD (Gemeentelijke gezondheidsdienst ) (zie de het LCI-draaiboek Hepatitis B-vaccinatieprogramma risicogroepen).
Voor risicovormende beroepen in de zorg dient het vaststellen van de vaccinatiestatus onderdeel van de aanstellingskeuring te zijn. Dit wordt beschreven in de Landelijke richtlijn Preventie iatrogene transmissie van hepatitis B. De werkgever van risicovormers in de gezondheidszorg en de werknemer zijn beiden verantwoordelijk voor het voorkomen van HBV-transmissie naar een patiënt. Dit wordt eveneens beschreven in de Landelijke richtlijn Preventie iatrogene transmissie van hepatitis B. Als de gezondheidszorgwerker zelfstandig risicovolle handelingen verricht is deze hier alleen voor verantwoordelijk. Het beleid kan praktisch als volgt worden samengevat:
- Elke risicovormer moet gevaccineerd zijn tegen hepatitis B, met controle van de respons;
- Bij non-responders (anti-HBs-titer van < 10 IE/L) en hypo-responders (een anti-HBs-titer tussen de 10 en 99 IE/L) moet gecontroleerd worden of er een infectie is met HBV;
- In geval van HBV-infectie moet bepaald worden of de risicovormer kan doorwerken;
- Een risicovormende non-/hyporesponder zonder HBV-infectie kan doorwerken, mits deze persoon ieder kwartaal gecontroleerd wordt op afwezigheid van HBV-infectie;
- De werkgever is verantwoordelijk voor een efficiënte registratie van gevaccineerde personen met inachtneming van de privacywetgeving.
Maatregelen op het werk
Wering van werk
Een zorgwerker die infectieus is voor HBV moet afzien van risicovormende handelingen, ook bij afwezigheid van symptomen, zoals staat beschreven in de landelijke richtlijn Preventie van transmissie van hepatitis B-virus door risicovormend medisch personeel. Meestal maakt het instellen van therapie met antivirale middelen de hervatting van het risicovormende werk op termijn mogelijk. De betrokken gezondheidszorgwerker zelf en bedrijfsarts/arbodienst zijn verantwoordelijk voor de controle van de mate van viremie conform het beleid beschreven in de richtlijn. Met betrekking tot personen die nog een beroep moeten kiezen, is het advies een zorgvuldige afweging te maken. In geval van HBV-dragerschap past, in verband met de betrokken risico’s, terughoudendheid bij de keuze voor en toelating tot een opleiding tot een risicovormend beroep, ook indien er sprake is van lage viremie (RIVM 2021).
Melden als beroepsziekte
Indien de ziekte (waarschijnlijk) is opgelopen tijdens de beroepsuitoefening moet dit door een bedrijfsarts worden gemeld bij het Nederlands Centrum voor Beroepsziekten (NCvB). Tussen 2014 en 2024 zijn er bij het NCvB (Nederlands Centrum voor Beroepsziekten ) geen werkgerelateerde HBV-infecties gemeld. HBV is meldingsplichtig. Door de GGD is van 2018 tot en met 2023 een aantal van 5.938 infecties met HBV gemeld, waarvan mogelijk 47 werkgerelateerd. Er zijn geen landelijke gegevens beschikbaar over het aantal prik-, bijt-, spat- of seksincidenten die aanleiding waren tot richtlijnconforme passieve immunisatie of actieve vaccinatie, terwijl bekend is dat er wel potentiële werkgerelateerde blootstellings-incidenten zijn.
Literatuur
- Ahn J, Gish RG. Hepatitis D Virus: A Call to Screening. Gastroenterol Hepatol (N Y) 2014; 10 (10): 647-686.
- Alexander JM, Ramus R, Jackson G, Sercely B, Wendel GD. Risk of hepatitis B transmission after amniocentesis in chronic hepatitis B carriers. Inf Dis Obstet Gynaecol 1999; 7 (6): 283-286. DOI: 10.1155/S1064744999000526.
- Asensio F, Bayas JM, Bertran MJ, Asenjo MA. Prevalence of hepatitis B infection in long-stay mentally handicapped adults. Eur J Epidemiol 2000; 16 (8): 725-729. DOI: 10.1023/a:1026793900057.
- Beasley RP. Rocks along the road to the control of HBV and HCC. Ann Epidemiol 2009; 19 (4): 231-234. DOI: 10.1016/j.annepidem.2009.01.017.
- Belopolskaya M, Avrutin V, Kalinina O, Dmitriev A, Gusev D. Chronic hepatitis B in pregnant women: Current trends and approaches. World J Gastroenterol 2021; 27 (23): 3279-3289. DOI: 10.3748/wjg.v27.i23.3279.
- Bertino JS et al. A Comparative trial of standard or high-dose S subunit recombinant hepatitis B vaccine versus a vaccine containing S subunit, pre-S1, and pre-S2 particles voor revaccination of healthy adult nonresponders. J Inf Dis 1997; 175 (3): 678-681. DOI: 10.1093/infdis/175.3.678.
- Bond WW, Favero MS, Petersen NJ, Gravelle CR, Ebert JW, Maynard JE. Survival of hepatitis B virus after drying and storage for one week. Lancet 1981; 1 (8219): 550-551. DOI: 10.1016/s0140-6736(81)92877-4.
- Borgia G, Carleo MA, Gaeta GB, et al. Hepatitis B in pregnancy. World J Gastroenterol 2012; 18 (34): 4677-4683. DOI: 10.3748/wjg.v18.i34.4677.
- CDC/Centers for Disease Control and Prevention. Sexually transmitted infections treatment guidelines, 2021. MMWR (Morbidity and Mortality Weekly Report ) recomm Rep 2021; 70 (RR-4): 1-187.
- CDC/Centers for Disease Control and Prevention. Updated U.S. Public health service guidelines for the management of occupational exposures to HBV, HCV and HIV and recommendations for postexposure prophylaxis. MMWR 2001; 50 (RR-11): 1-52.
- CDNA/Communicable Disease Network Australia. Hepatitis B,CDNA National Guidelines for Public Health Units. CDNA 2017.
- Chan OK, Lao TT, Suen SS, Lau TK, Leung TY. Knowledge on hepatitis B infection among pregnant women in a high endemicity area. Patient Educ Couns 2011; 85 (3): 516-520. DOI: 10.1016/j.pec.2010.11.006.
- Chang MH. Breakthrough HBV infection in vaccinated children in Taiwan: surveillance for HBV mutants. Antivir Ther 2010; 15 (3 Pt B): 463-469. DOI: 10.3851/IMP1555.
- Chang Y, Jeong SW, Jang JY. Hepatitis B Virus Reactivation Associated With Therapeutic Interventions. Front Med (Lausanne) 2022; 8: 770124. DOI: 10.3389/fmed.2021.770124.
- Chen X, Chen J, Wen J, Xu C, Zhang S, Zhou YH, Hu Y. Breastfeeding is not a risk factor for mother-to-child transmission of hepatitis B virus. PLoS One 2013; 8 (1): e55303. DOI: 10.1371/journal.pone.0055303.
- Chowdhury SD, Eapen CE. Perinatal transmission of Hepatitis B. Hep B Annual 2009; 6: 80-88.
- Cohen PR. Tattoo-Associated Viral Infections: A Review. Clin Cosmet Investig Dermatol 2021; 14: 1529-1540. DOI: 10.2147/CCID.S284796.
- Daida YG, Boscarino JA, Moorman AC, Lu M, Rupp LB, Gordon SC, et al. Mental and physical health status among chronic hepatitis B patients. Qual Life Res 2020; 29 (6): 1567-1577. DOI: 10.1007/s11136-020-02416-6.
- Davidson SS, Benjamin Jr. WH. Risk of infection and tracking of work-related infectious diseases in the funeral industry. Am J Infect Control 2006; 34 (10): 655-660. DOI: 10.1016/j.ajic.2006.05.290.
- Dimmendaal D, Urbanus AT, Beekmans N, et al. Heropsporingsprojecten van chronische hepatitis B-patiënten langs de lat. Infectieziekten Bulletin 2019; 30 (4).
- Douwes M, Van den Heuvel S, Sonneveld H. Het grote gevaar van de zorg: Overzicht van arbeidsrisico’s van en maatregelen voor verpleegkundigen en verzorgenden. Hoofddorp: TNO Kwaliteit van leven, arbeid; 2008. Beschikbaar via: publications.tno.nl/publication/34612052/bt41zH/douwes-2008-grote.pdf.
- Edwards S, Carne C. Oral sex and the transmission of viral STIs. Sex Transm Infect 1998; 74 (1): 6-10. DOI: 10.1136/sti.74.1.6.
- EASL/European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017; 67 (2): 370-398. DOI: 10.1016/j.jhep.2017.03.021.
- Farci P, Niro GA. Clinical features of hepatitis D. Semin Liver Dis 2012 Aug; 32 (3): 228-236.
- Fattovich G, Brollo L, Giustina G, Noventa F, Pontisso P, Alberti A, et al. Natural history and prognostic factors for chronic hepatitis type B. Gut 1991; 32 (3): 294-298.
- Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology 2004; 127 (5 Suppl 1): S35-50.
- de Franchis R, Hadengue A, Lau G, Lavanchy D, Lok A, McIntyre N, et al. EASL International Consensus Conference on Hepatitis B. 13-14 September, 2002 Geneva, Switzerland. Consensus statement (long version). J Hepatol 2003; 39 (Suppl 1): S3-25.
- Gambarin-Gelwan M. Hepatitis B in pregnancy. Clinical Liver Disease 2007; 11: 945-963.
- Ganem D, Prince AM. Hepatitis B virus infection—natural history and clinical consequences. N Engl J Med 2004; 350 (11): 1118-1129.
- GBD 2019 Hepatitis B Collaborators. Global, regional, and national burden of hepatitis B, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Gastroenterol Hepatol 2022 Sep; 7 (9): 796-829.
- Ghany MG, King WC, Lisker-Melman M, et al. Comparison of HBV RNA and hepatitis B core related antigen with conventional HBV markers among untreated adults with chronic hepatitis B in North America. Hepatology 2021; 74: 2395-2409.
- Haber P, Schillie S. Chapter 10: Hepatitis B. In: Centre of Disease Control. Epidemiology and prevention of vaccine-preventable diseases, 14th edition. CDC 2021. Via link: https://www.cdc.gov/pinkbook/hcp/table-of-contents/chapter-10-hepatitis….
- Hahné SJ, De Melker HE, Kretzschmar M, Mollema L, Van Der Klis FR, Van Der Sande MA, Boot HJ. Prevalence of hepatitis B virus infection in The Netherlands in 1996 and 2007. Epidemiol Infect 2012 Aug; 140 (8): 1469-1480.
- Handsfield HH. Hepatitis A and B immunization in persons being evaluated for sexually transmitted diseases. Am J Med. 2005 Oct; 118 (Suppl 10A): 69S-74S.
- Heijtink RA, Van Hattum J, Schalm SW, Masurel N. Co-occurence of HBsAg and anti-HBs: two consecutive infections or a sign of advanced chronic liver disease? J Med Virol 1982; 10: 83-90.
- Henkle E, Lu M, Rupp LB, Boscarino JA, Vijayadeva V, Schmidt MA, Gordon SC; Chronic Hepatitis Cohort Study (CHeCS) Investigators. Hepatitis A and B immunity and vaccination in chronic hepatitis B and C patients in a large United States cohort. Clin Infect Dis 2015 Feb 15; 60 (4): 514-522.
- Hollinger FB, Lau DT. Hepatitis B: the pathway to recovery through treatment. Gastroenterol Clin North Am 2006; 35 (4): 895-931.
- Iannacone M, Guidotti LG. Immunobiology and pathogenesis of hepatitis B virus infection. Nat Rev Immunol 2022; 22: 19-32.
- Ibrahim Y, Umstead M, Wang S, Cohen C. The Impact of Living With Chronic Hepatitis B on Quality of Life: Implications for Clinical Management. J Patient Exp 2023; 10: 23743735231211069. https://doi.org/10.1177/23743735231211069.
- Jeng WJ, Papatheodoridis GV, Lok ASF. Hepatitis B. Lancet 2023 Mar 25; 401 (10381): 1039-1052. doi: 10.1016/S0140-6736(22)01468-4. Epub 2023 Feb 9. PMID: 36774930.
- Jiang X, Chang L, Yan Y, Wang L. Paradoxical HBsAg and anti-HBs coexistence among Chronic HBV Infections: Causes and Consequences. Int J Biol Sci 2021 Mar 11; 17 (4): 1125-1137.
- Jonas MM. Hepatitis B and pregnancy: an underestimated issue. Liver Int 2009; 29 Suppl 1: 133-139.
- Kayaert L, Sarink D, Visser M, et al. Sexually transmittend infections in the Netherlands in 2023. RIVM 2024.
- Kidd-Ljunggren K, Holmberg A, Bläckberg J, Lindqvvist B. High levels of hepatitis B virus DNA in body fluids from chronic carriers. Journal of Hospital Infection 2006;64:352-357.
- Klous G, McDonald S, De Boer P. Staat van Infectieziekten in Nederland, 2021. RIVM 2022.
- Knutsson M, Kidd-Ljunggren K. Urine from chronic hepatitis B virus carriers: implications for infectivity. J Med Virol. 2000 Jan;60(1):17-20.
- Komatsu H, Inui A, Sogo T, Tateno A, Shimokawa R, Fujisawa T. Tears from children with chronic hepatitis B virus (HBV) infection are infectious vehicles of HBV transmission: experimental transmission of HBV by tears, using mice with chimeric human livers. J Infect Dis. 2012 Aug 15;206(4):478-85.
- Komiya Y, Katayama K, Yugi H, Mizui M, Matsukura H, Tomoguri T, et al. Minimum infectious dose of hepatitis B virus in chimpanzees and difference in the dynamics of viremia between genotype A and genotype C. Transfusion. 2008;48(2):286-94. Epub 2007/11/22.
- Liang TJ. Hepatitis B: the virus and disease. Hepatology. 2009 May;49(5 Suppl):S13-21.
- Lin CL, Kao JH. Natural history of acute and chronic hepatitis B: the role of HBV genotypes and mutants. Best Pract Res Clin Gastroenterol 2017; 31: 249-255.
- Lok ASF, McMahon BJ. Chronic hepatitis B. AASLD Pratice guidelines. Hepatology 2007; 54(2):507-539.
- Magnius L, Mason WS, Taylor J, Kann M, Glebe D, Dény P, Sureau C, Norder H, Ictv Report Consortium. ICTV Virus Taxonomy Profile: Hepadnaviridae. J Gen Virol. 2020 Jun;101(6):571-572.
- Mahboobi N, Porter SR, Karayiannis P, Alavian SM. Oral fluid and hepatitis A, B and C: a literature review. J Oral Pathol Med. 2012 Aug;41(7):505-16.
- Malsam R, Nienhaus A. Occupational Infections among Dental Health Workers in Germany—14-Year Time Trends. International Journal of Environmental Research and Public Health. 2021; 18 (19): 10128.
- Marfatia YS, Pandya I, Mehta K. Condoms: Past, present, and future. Indian J Sex Transm Dis AIDS. 2015 Jul-Dec;36(2):133-9.
- Marschall T, Kretzschmar M, Mangen MJJ, Schalm S. High impact of migration on the prevalence of chronic hepatitis B in the Netherlands. Submitted 2007.
- Mason WS, Gill US, Litwin S, Zhou Y, Peri S, Pop O, et al. HBV DNA integration and clonal hepatocyte expansion in chronic hepatitis B patients considered immune tolerant. Gastroenterology 2016;151:986-998.
- McMahon BJ, Holck P, Bulkow L, Snowball M. Serologic and clinical outcomes of 1536 Alaska natives chronically infected with hepatitis B virus. Annals of Internal Medicine 2001;135(9):759-768.
- Morris J, Duckworth GJ, Ridgway GL. Gastrointestinal endoscopy decontamination failure and the risk of transmission of blood-borne viruses: a review. J Hosp Infec 2006; (63):1-13.
- Mortimer PP: Arsphenamine jaundice and the recognition of instrument-borne virus infection. Genitourin Med 1995;71:109-119.
- Nationale Drug Monitor, editie 2023. Trimbos-instituut, Utrecht & WODC, Den Haag.
- NCvB. Achtergronddocument bij registratierichtlijn C001 Werkgebonden Hepatiden Hepatitis B. 2011.
- Oketani M, Uto H, Ido A, et al. Management of hepatitis B virus related acute liver failure. Clinical Journal of Gastroenterology 2014;7:19-26
- de Oliveira PR, Yamamoto AY, de Souza CB, de Araújo NM, de Andrade Gomes S, Heck AR, de Castro Figueiredo JF, Mussi-Pinhata MM. Hepatitis B viral markers in banked human milk before and after Holder pasteurization. J Clin Virol 2009; 45: 281-284.
- Ott JJ, Horn J, Krause G, Mikolajczyk RT. Time trends of chronic HBV infection over prior decades—a global analysis. J Hepatol 2017; 66: 48-54
- Overheid. Arbeidsomstandighedenbesluit: Hoofdstuk 4. Gevaarlijke stoffen en biologische agentia. Den Haag, 2024.
- Pan CQ et al. Tenofovir to prevent hepatitis B transmission in mothers with high viral load. N Engl J Med 2016; 374: 2324-2334.
- Pappas SC. Fulminant viral hepatitis. Gastroenterology clinics of North America 1995;24(1):161-173.
- Pintilie H, Brook G. Commentary: A review of risk of hepatitis B and C transmission through biting or spitting. J Viral Hepat. 2018 Dec;25(12):1423-1428.
- Pluijmaekers, A. J. M., & De Melker, H. E. (2023). The National Immunisation Programme in the Netherlands. Surveillance and developments in 2022-2023
- Pol S. Management of HBV in immunocompromised patients. Liver Int. 2013 Feb;33 Suppl 1:182-7.
- Pyrsopoulos NT, Reddy KR. Extrahepatic manifestations of chronic viral hepatitis. Curr Gastroenterol Rep. 2001;3(1):71-78.
- Qin Y, Liao P. Hepatitis B virus vaccine breakthrough infection: surveillance of S gene mutants of HBV . Acta Virol. 2018;62(2):115-121.
- Raffetti E, Fattovich G, Donato F. Incidence of hepatocellular carcinoma in untreated subjects with chronic hepatitis B: a systematic review and meta-analysis. Liver Int 2016;36:1239-1251.
- Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. European Crohn's and Colitis Organisation (ECCO). Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 2014 Jun;8(6):443-68.
- Ranger-Rogez S, Denis F. Hepatitis B mother-to-child transmission. Expert Review of Anti-Infective Therapy 2004; 2: 133-45.
- Remis RS, Dufour A, Alary M, Vincelette J, Otis J, Mâsse B, Turmel B, LeClerc R, Parent R, Lavoie R. Association of hepatitis B virus infection with other sexually transmitted infections in homosexual men. Omega Study Group. Am J Public Health. 2000 Oct;90(10):1570-4.
- Rempel S, Murti M, Buxton JA, Stephens W, Watterson M, Andonov A, Fung C, Ramler G, Bigham M, Lem M. Outbreak of acute hepatitis B virus infection associated with exposure to acupuncture. Can Commun Dis Rep. 2016 Aug 4;42(8):169-172.
- RIVM. Draaiboek Hepatitis B-vaccinatieprogramma risicogroepen. Bilthoven, 2024. Beschikbaar via: lci.rivm.nl/draaiboeken/hepatitis-b-vaccinatieprogramma-risicogroepen.
- RIVM. Hygiënerichtlijn voor seksbedrijven en sekswerkers. Bilthoven, 2019. Beschikbaar via: rivm.nl/hygienerichtlijnen/seksbedrijven-sekswerkers.
- RIVM. Landelijke richtlijn Prikaccidenten. Bilthoven, 2019. Beschikbaar via: lci.rivm.nl/richtlijnen/prikaccidenten.
- RIVM. Landelijke richtlijn preventie transmissie van hepatitis B van medisch personeel naar patiënten. Bilthoven, 2021. Beschikbaar via: lci.rivm.nl/richtlijnen/richtlijn-preventie-iatrogene-transmissie-hepatitis-b.
- Sabeena S, Ravishankar N. Horizontal Modes of Transmission of Hepatitis B Virus (HBV): A Systematic Review and Meta-Analysis. Iran J Public Health. 2022 Oct;51(10):2181-2193.
- Sinn DH, Kang D, Guallar E, et al. Alcohol intake and mortality in patients with chronic viral hepatitis: a nationwide cohort study. Am J Gastroenterol 2021; 116: 329-335.
- Smalls DJ, Kiger RE, Norris LB, Bennett CL, Love BL. Hepatitis B Virus Reactivation: Risk Factors and Current Management Strategies. Pharmacotherapy. 2019 Dec;39(12):1190-1203.
- SRI. Richtlijn Accidenteel bloedcontact. Bilthoven, 2024. Beschikbaar via: sri-richtlijnen.nl/accidenteel-bloedcontact.
- Sun HY, Sheng WH, Tsai MS, Lee KY, Chang SY, Hung CC. Hepatitis B virus coinfection in human immunodeficiency virus-infected patients: a review. World J Gastroenterol. 2014 Oct 28;20(40):14598-614.
- Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology 2018; 67: 1560-1599.
- Than TT, Jo E, Todt D, Nguyen PH, Steinmann J, Steinmann E, Windisch MP. High Environmental Stability of Hepatitis B Virus and Inactivation Requirements for Chemical Biocides. J Infect Dis. 2019 Mar 15;219(7):1044-1048.
- Thio CL, Hawkins C. Chapter 145 Hepatitis B virus. In: Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. Elsevier - OHCE, 2019.
- Thomas DL. Global elimination of chronic hepatitis. N Engl J Med 2019; 380: 2041-2050.
- Tillmann HL, Patel K. Therapy of acute and fulminant hepatitis B. Intervirology. 2014;57(3-4):181-8.
- Tostmann A, Freidl GS, Goosen S, et al. Immuniteit tegen infectieziekten bij asielzoekers. Ned Tijdschr Geneeskd. 2019;163:D3678.
- Trépo C, Chan HL, Lok A. Hepatitis B virus infection. Lancet. 2014 Dec 6;384(9959):2053-63.
- Tsukuda S, Watashi K. Hepatitis B virus biology and life cycle. Antiviral Res. 2020 Oct;182:104925.
- Tufon KA, Meriki HD, Kwenti TE, Tony NJ, Malika E, Bolimo AF, Kouanou YS, Nkuo-Akenji T, Anong DN. HBV Transmission Risk Assessment in Healthcare Workers, Household and Sexual Contacts of HBV Infected Patients in the Southwest Region of Cameroon. Oman Med J. 2019 Jul;34(4):313-321.
- Van Sighem AI (aviaire influenza (vogelgriep) ), Wit FWNM, Boyd A, Smit C, Matser A, Van der Valk M. HIV Monitoring Report 2022. Human Immunodeficiency Virus (HIV) Infection in the Netherlands. Amsterdam: stichting hiv monitoring, 2022.
- Vermeiren AP, Hoebe CJ, Dukers-Muijrers NH. High non-responsiveness of males and the elderly to standard hepatitis B vaccination among a large cohort of healthy employees. J Clin Virol. 2013 Sep;58(1):262-4.
- Viganò M, Grossi G, Loglio A, Lampertico P. Treatment of hepatitis B: is there still a role for interferon? Liver Int 2018; 38 (suppl 1): 79-83.
- Visser M, van der Ploeg CPB, Smit C, Hukkelhoven CWPM, Abbink F, van Benthem BHB, Op de Coul ELM. Evaluating progress towards triple elimination of mother-to-child transmission of HIV, syphilis and hepatitis B in the Netherlands. BMC Public Health 2019 Mar 29; 19 (1): 353.
- Wang JS, Chen H, Zhu QR. Transformation of hepatitis B se rologic markers in babies born to hepatitis B surface antigen positive mothers. World J Gastroenterol 2005; 11: 3582.
- WHO/World Health Organization. Global health sector strategy on viral hepatitis 2016-2021. Towards ending viral hepatitis. 2016.
- WHO/World Health Organization. Hepatitis B. 2023. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
- van Wijk PTL, Schneeberger PM, Heimeriks K, Boland GJ, Karagiannis I, Geraedts J, Ruijs WLM. Occupational blood exposure accidents in the Netherlands. Eur J Public Health 2010; 20 (3): 281-287. https://doi.org/10.1093/eurpub/ckp163.
- Wiseman E, Fraser MA, Holden S, Glass A, Kidson BL, Heron LG, Maley MW, Ayres A, Locarnini SA, Levy MT. Perinatal transmission of hepatitis B virus: an Australian experience. Med J Aust. 2009 May 4;190(9):489-92.
- Wong GL, Wong VW, Yuen BW, et al. An aging population of chronic hepatitis B with increasing comorbidities: a territory-wide study from 2000 to 2017. Hepatology 2020; 71: 444-455.
- Wong RJ, Brosgart CL, Welch S, et al. An updated assessment of chronic hepatitis B prevalence among foreign-born persons living in the United States. Hepatology 2021; 74: 607-626.
- Wu CH, Huang WC, Chen CH, Lu SN. Outcomes of hepatitis B immunoglobulin and hepatitis B vaccination in high-risk newborns born to HBeAg-positive mothers. Biomed J. 2022 Oct;45(5):798-805.
- Xu DZ, Yan YP, Choi BCK, Xu JQ, Men K, Zhang JX, et al. Risk factors and mechanisms of transplacental transmission of hepatitis B virus: a case control study. J Med Vir 2002; 67: 20-26.
- Yang HI, Hung HL, Lee MH, et al. Incidence and determinants of spontaneous seroclearance of hepatitis B e antigen and DNA in patients with chronic hepatitis B. Clin Gastroenterol Hepatol 2012; 10: 527-534.
- Yeo YH, Tseng TC, Hosaka T, et al. Incidence, factors, and patient-level data for spontaneous HBsAg seroclearance: a cohort study of 11,264 patients. Clin Transl Gastroenterol 2020; 11: e00196.
- Zaaijer HL, Isken, LD en Boot, HJ. Transmissie van hepatitis B door HBsAgnegatieve donor opgespoord na de invoering van donorscreening op HBV-DNA, Infectieziekten Bulletin 2010; jaargang 21, nummer 4: 117-118.
- Zaaijer HL, Lelie PN, Vandenbroucke-Grauls CM, Koot M. Concurrence of hepatitis B surface antibodies and surface antigen: implications for postvaccination control of health care workers. J Viral Hepat 2002; 9(2):146-148.
- Zheng JS, Chen MM, Yang HF, Zhou XT, Liu YY, Li JB. Stool vs. Serum Hepatitis B Virus DNA in Patients with Chronic Hepatitis B. Med Sci Monit. 2015 Dec 9;21:3840-6.
- Zou H, Chen Y, Duan Z, Zhang H. Protective effect of hepatitis B vaccine combined with two-dose hepatitis B immunoglobulin on infants born to HBsAg-positive mothers. PLoS One. 2011;6(10):e26748.